 对照组和研究组, 各54例。对照组患儿使用枯草杆菌二联活菌颗粒治疗, 研究组患儿在对照组基础上使用布拉氏酵母菌治疗。比较两组患儿临床疗效及治疗3、5、7 d后大便次数与腹泻持续时间及治疗前后免疫功能。结果 研究组患儿总有效率为96.3%, 明显高于对照组的85.2%, 差异具有统计学意义(P<0.05)。研究组患儿治疗3、5、7 d后大便次数明显少于对照组, 腹泻持续时间为(2.7±1.4)d, 明显短于对照组的(4.8±1.8)d, 差异具有统计学意义(P<0.05)。治疗前, 两组患儿CD3+、CD4+、CD8+及CD4+/CD8+比较, 差异无统计学意义(P>0.05);治疗后, 两组患儿CD3+、CD4+、CD8+及CD4+/CD8+优于治疗前, 且研究组患儿CD3+、CD4+、CD8+及CD4+/CD8+明显优于对照组, 差异具有统计学意义(P<0.05)。结论 布拉氏酵母菌在小儿肺炎合并继发性腹泻中的应用效果更为理想, 值得在临床上广泛宣传与使用。
对照组和研究组, 各54例。对照组患儿使用枯草杆菌二联活菌颗粒治疗, 研究组患儿在对照组基础上使用布拉氏酵母菌治疗。比较两组患儿临床疗效及治疗3、5、7 d后大便次数与腹泻持续时间及治疗前后免疫功能。结果 研究组患儿总有效率为96.3%, 明显高于对照组的85.2%, 差异具有统计学意义(P<0.05)。研究组患儿治疗3、5、7 d后大便次数明显少于对照组, 腹泻持续时间为(2.7±1.4)d, 明显短于对照组的(4.8±1.8)d, 差异具有统计学意义(P<0.05)。治疗前, 两组患儿CD3+、CD4+、CD8+及CD4+/CD8+比较, 差异无统计学意义(P>0.05);治疗后, 两组患儿CD3+、CD4+、CD8+及CD4+/CD8+优于治疗前, 且研究组患儿CD3+、CD4+、CD8+及CD4+/CD8+明显优于对照组, 差异具有统计学意义(P<0.05)。结论 布拉氏酵母菌在小儿肺炎合并继发性腹泻中的应用效果更为理想, 值得在临床上广泛宣传与使用。
【关键词】 布拉氏酵母菌;肺炎;继发性腹泻;效果;大便次数
DOI:10.14163/j.cnki.11-5547/r.2019.22.048
小儿肺炎是临床儿科常见的呼吸系统疾病, 常用抗菌药治疗, 但因小儿肠道和免疫功能不成熟, 常导致抗微生物能力严重下降, 易使肠道菌群发生紊乱, 甚至出现继发性腹泻, 该疾病多发于<3岁的儿童[1]。近几年临床出现了新型广泛使用的微生态制剂布拉氏酵母菌, 该药物属于真菌类肠道微生态制剂, 可以改善患儿肠道菌群紊乱、继发性腹泻等症状, 同时有利于缩短患儿腹泻持续时间, 减少患儿大便次数[2]。本院采用布拉氏酵母菌治疗小儿肺炎合并继发性腹泻效果更佳, 现报告如下。
1 资料与方法
1. 1 一般资料 选取2017年9月~2018年9月本院收治的108例肺炎合并继发性腹泻患儿, 纳入标准:①患儿均符合相关的肺炎合并继发性腹泻诊断标准[3];②患儿年龄3个月~3岁;③患儿家长均知晓同意此次研究。排除标准:①对本次使用的治疗药物存在过敏反应患儿;②存在先天性心脏病患儿;③消化系统存在异常患儿;④有严重的呼吸道疾病患儿;⑤近期使用微生态制剂治疗的患儿。将患儿随机分为对照组和研究组, 各54例。对照组患儿男30例, 女24例;年龄3个月~3岁, 平均年龄(1.3±0.6)岁;病程1~46 h, 平均病程(25.4±6.9)h。研究组患儿男34例, 女20例;年龄4个月~3岁, 平均年龄(1.1±0.7)岁;病程1.5~48.0 h, 平均病程(24.6±7.8)h。两组患儿一般资料比较, 差异无统计学意义(P>0.05), 具有可比性。本研究完全通过了本院伦理委员会审核批准。
1. 2 方法 兩组患儿入院后均接受相关常规治疗, 如止咳、平喘、吸氧、抗感染、雾化治疗等。在此基础上, 对照组患儿使用枯草杆菌二联活菌颗粒(北京韩美药品有限公司, 国药准字S20020037)治疗, 口服, 1 g/次, 1次/d, 连续治疗5 d。研究组患儿在对照组基础上使用布拉氏酵母菌(法国百科达制药厂, 注册证号S20100086)治疗, 口服, 0.25 g/次, 1次/d[4], 连续治疗5 d。在治疗前及治疗结束后采集两组患儿空腹静脉血3 ml, 应用免疫荧光标记法对患儿的CD3+、CD4+、CD8+水平进行检测, 同时计算CD4+ /CD8+比值。
1. 3 观察指标及疗效判定标准 ①比较两组患儿临床疗效, 显效:治疗后3 d患儿的大便性状、排便次数完全恢复, 临床症状完全消失;有效:治疗后3 d患儿的大便性状、排便次数较治疗前有很大改善, 临床症状较治疗前有所减少;无效:治疗后3 d患儿的大便性状、排便次数无明显变化, 临床症状无明显变化, 症状甚至更加严重[5]。总有效率=(显效+有效)/总例数×100%。②比较两组患儿治疗3、5、7 d后大便次数与腹泻持续时间。③比较两组患儿治疗前后免疫功能, 主要包括CD3+、CD4+、CD8+及CD4+/CD8+。
1. 4 统计学方法 采用SPSS18.0统计学软件对数据进行统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验;计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
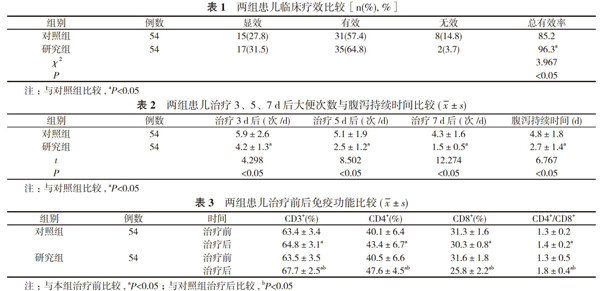
2. 1 两组患儿临床疗效比较 研究组患儿总有效率为96.3%, 明显高于对照组的85.2%, 差异具有统计学意义(P<0.05)。见表1。
2. 2 两组患儿治疗3、5、7 d后大便次数与腹泻持续时间比较 研究组患儿治疗3、5、7 d后大便次数明显少于对照组, 腹泻持续时间为(2.7±1.4)d, 明显短于对照组的(4.8±1.8)d, 差异具有统计学意义(P<0.05)。见表2。
2. 3 两组患儿治疗前后免疫功能比较 治疗前, 两组患儿CD3+、CD4+、CD8+及CD4+/CD8+比较, 差异无统计学意义(P>0.05);治疗后, 两组患儿CD3+、CD4+、CD8+及CD4+/CD8+优于治疗前, 且研究组患儿CD3+、CD4+、CD8+及CD4+/CD8+明显优于对照组, 差异具有统计学意义(P<0.05)。见表3。
3 讨论
肺炎属于儿科常见呼吸道疾病, 临床常采用抗菌药物进行抗感染治疗, 但患儿在治疗期间容易发生腹泻, 发生继发性腹泻的病机主要为:①抗菌药物的刺激:抗菌药物中残留的药物存在活性, 会对患儿的肠道和胃黏膜造成损伤, 从而降低各种酶活性, 使肠道绒毛发生萎缩, 且残留药物与胆汁结合后会抑制肠胃的脂肪吸收能力, 容易引发继发性腹泻。部分抗菌药可能还会刺激胃动力受体, 促进肠胃蠕动, 继而引发腹泻。②肠道内菌群平衡状态被打破:婴幼儿时期, 患儿的各项身体机能尚未发育完善, 胃肠道保护屏障发育不够成熟, 体内的免疫球蛋白A(IgA)含量、血清免疫球蛋白水平也较低, 容易受到外界因素的影响, 加之应用抗菌药物可抑制患儿肠道内益生菌的生长, 加快有害菌的生长繁殖, 从而使得肠道的氨类、毒素物质产生较多, 直接损伤胃肠道黏膜, 间接引发腹泻。③肠道代谢发生异常:使用抗菌药物后患儿肠道内的厌氧菌数量会明显减少, 肠道内的多糖分解功能会严重下降, 导致碳水化合物、胆汁酸代谢发生异常, 同时厌氧菌数量的减少还会引发分泌性腹泻。近年临床多采用微生态制剂对患儿进行治疗, 不仅可以有效为患儿肠道提供有益细菌, 促使患儿肠道菌群恢复稳定, 而且可以增强患儿身体免疫力, 在患儿肠道内建立保护屏障从而防止病原菌再次侵入。
本研究结果显示, 研究组患儿总有效率为96.3%, 明显高于对照组的85.2%, 差异具有统计学意义(P<0.05)。研究组患儿治疗3、5、7 d后大便次数明显少于对照组, 腹泻持续时间为(2.7±1.4)d, 明显短于对照组的(4.8±1.8)d, 差异具有统计学意义(P<0.05)。说明应用布拉氏酵母菌治疗小儿肺炎合并继发性腹泻可以有效提高临床疗效, 改善患儿预后;有利于改善患儿肠道, 促进排便功能恢复正常。布拉氏酵母菌属于微生态制剂, 可以发挥以下作用:①可以有效促进糖蛋白、蛋白磷酸酶的分泌, 刺激肠道黏膜分泌更多的免疫球蛋白、IgA等, 同时可以刺激补体, 增强胃肠黏膜的免疫应答反应, 布拉氏酵母菌还具有广泛抗炎性反应的作用。②布拉氏酵母菌可以钝化部分细菌产生的毒素, 刺激肠道释放有益于肠道的物质, 不断为肠道黏膜提供养分, 提高肠道绒毛的双糖酶生物活性, 加快糖代谢并促进受损黏膜恢复[6]。③患儿服用布拉氏酵母菌3 d后, 其在肠道内的浓度逐渐稳定, 加快肠道黏膜的修复和肠道内过氧化氢的分解速度, 此外还可有效促使肠道内有益菌生长繁殖加快, 有利于不断改善患儿肠道内情况, 建立肠胃黏膜保护屏障, 减少患儿排便次数, 缩短腹泻持续时间等[7]。④布拉氏酵母菌可以黏附各种病毒与细菌, 抑制各种病原微生物的生长。另外, 患儿不再服用布拉氏酵母菌后益生菌不会继续留在患儿的肠道内, 安全性较高。本研究结果显示, 治疗后, 两组患儿CD3+、CD4+、CD8+及CD4+/CD8+优于治疗前, 且研究组患儿CD3+、CD4+、CD8+及CD4+/CD8+明显优于对照组, 差异具有统计学意义(P<0.05)。说明应用布拉氏酵母菌治疗小儿肺炎合并继发性腹泻, 可以有效改善患儿免疫状况, 有利于促进患儿恢复。小儿肺炎合并继发性腹泻发生的过程中, 免疫细胞发挥了非常重要的作用, 成熟T细胞的重要标志为CD3+, CD8+的作用主要是抑制B细胞活化, 抑制T细胞抗体的释放、生长繁殖过程等, 有利于保持机体免疫应答反应正常, CD4+的作用是间接加快B细胞分泌抗体, 通常在Th细胞表面进行表达。患儿在发生小儿肺炎合并继发性腹泻后免疫功能会下降, 通常为各项免疫指标下降, 但是CD8+水平会上升, 因此在治疗小儿肺炎合并继发性腹泻期间, 不仅要进行对症治疗, 而且还要注重改善患儿的免疫功能, 以便提高治疗疗效, 改善患儿预后。
综上所述, 布拉氏酵母菌应用于小儿肺炎合并继发性腹泻的疗效更为理想, 值得在临床上广泛宣传与使用。
参考文献
[1] 王丹, 叶悄红, 郭琴. 布拉氏酵母菌辅助磷酸铝治疗小儿急性腹泻的临床观察. 中国药房, 2017, 28(23):3250-3254.
[2] Use of quantitative molecular diagnostic methods to identify causes of diarrhoea in children: a reanalysis of the GEMS case-control study. The Lancet, 2016, 388(10051):1291-1301.
[3] Ye Y, Tang H. Utilizing de Bruijn graph of metagenome assembly for metatranscriptome analysis. Bioinformatics, 2015, 32(7):1001-1008.
[4] Honour S , Hickling KMH. Naturally occurring Brucella suis biovar 4 infection in a moose (Alces alces). Journal of Wildlife Diseases, 2016, 29(4):596-598.
[5] Topp E , Irwin R , Mcallister T , et al. The case for plant-made veterinary immunotherapeutics. Biotechnology Advances, 2016, 34(5):597-604.
[6] Seddik HA, Ceugniez A, Bendali F, et al. Yeasts isolated from Algerian infants’s feces revealed a burden of Candida albicans species, non-albicans Candida species and Saccharomyces cerevisiae. Archives of Microbiology, 2016, 198(1):71-81.
[7] 黃少波. 布拉氏酵母菌预防婴幼儿抗生素相关性腹泻临床研究. 黑龙江医学, 2016, 40(5):431-432.
[收稿日期:2019-01-11]